半刺厚唇鱼(Acrossocheilius hemispinus)隶属鲤科(Cyprindae)、鲃亚科(Barbinae)、光唇鱼属(Acrossocheilius),主要分布在福建省的九龙江、闽江、霍童溪、交溪,以及湖南省的湘江、沅水、澧水、资水等水系[1],是闽北地区常见的土著名贵鱼类,肉质鲜美,具有较高的营养价值和经济价值。近年来,生态环境日益恶化及人为过度捕捞导致半刺厚唇鱼野生资源逐渐减少[2],因此非常有必要对其种质资源进行保护研究。目前,国内外对半刺厚唇鱼的研究主要集中在生物学特性[2]、急性毒性试验[3⇓⇓-6]、疾病防治[7-8]、人工繁殖[9-10]、胚胎发育[11]、营养与饲料[12⇓⇓-15]等方面,而有关其雌雄个体形态特征差异及雌雄鉴别还未见报道。本研究基于半刺厚唇鱼的形态性状指标,通过主成分分析、R-聚类分析、逐步判别分析及T检验等方法,对半刺厚唇鱼雌雄个体差异进行分析,建立性别判别方程,旨在为半刺厚唇鱼选育过程中雌雄鉴定提供科学方法和理论依据。
1 材料与方法
1.1 材料
本实验野生半刺厚唇鱼的来源均为使用刺网采集于闽江。其中雌鱼30尾,体质量范围为56.0~174.6 g;雄鱼30尾,体质量范围为58.7~148.7 g。通过解剖观察鱼体性腺的形态特征来确定雌雄。
1.2 实验方法
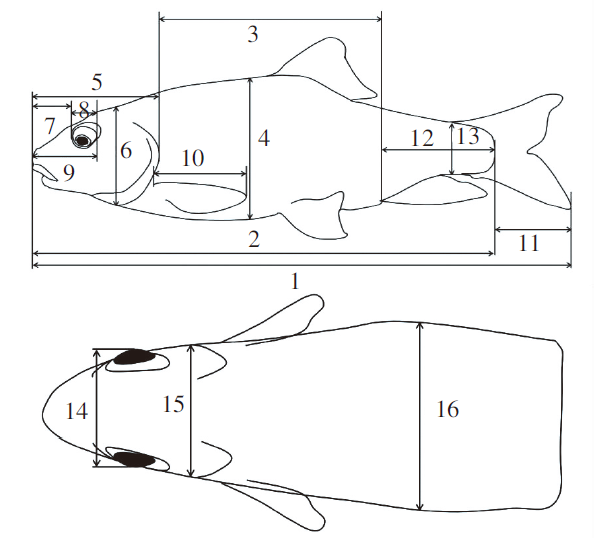
用直尺和游标卡尺测量全长(Total length,TL)、体长(Body length,BL)、躯干长(Trunk length,TL)、体高(Body depth,BD)、体厚(Body thickness,BT)、头长(Head length,HL)、头高(Head depth,HD)、头宽(Head breadth,HB)、吻长(Snout length,SL)、眼径(Eye diameter,ED)、眼间距(Eye cross,EC)、吻端至眼后沿垂直距离(Vertical distance from snout to posterior orbital,VDSOP)、胸鳍长(Pectoral fin length,PFL)、尾鳍长(Caudal fin length, CFL)、尾长(Caudal peduncle length,CPL)、尾柄高(Caudal peduncle depth,CPD)(图1)。用电子天平称量体质量(Body weight,BW),精确至0.1 g。
图1
图1
半刺厚唇鱼形态特征测量示意图
注:1.全长;2.体长;3.躯干长;4.体高;5.头长;6.头高;7.吻长;8.眼径;9.吻端至眼后沿垂直距离;10.胸鳍长;11.尾鳍长;12.尾长;13.尾柄高;14.眼间距;15.头宽;16.体厚。
Fig.1
Schematic diagram of morphological feature measurement of A. hemispinus
Notes: 1.TL; 2.BL; 3.TL; 4.BD; 5.HL; 6.HD; 7.SL; 8.ED; 9.VDSOP; 10.PFL; 11.CFL; 12.CPL; 13.CPD;14.EC; 15.HB; 16.BT.
1.3 数据处理
对采集的60尾样本的17个直接测量性状进行主成分分析,明确半刺厚唇鱼的形态指标体系,作出主成分分析图。为了消除半刺厚唇鱼个体大小对参数值的影响,将躯干部测量性状除以体长、头部测量性状除以头长转化为标准化性状[16],即体高/体长(BD/BL)、体厚/体长(BT/BL)、头长/体长(HL/BL)、胸鳍长/体长(PFL/BL)、尾鳍长/体长(CFL/BL)、尾柄高/体长(CFD/BL)、躯干长/体长(TL/BL)、头高/体长(HD/HL)、尾长/体长(CPL/BL)、头宽/头长(HB/HL)、眼间距/头长(EC/HL)、吻长/头长(SL/HL)、吻端至眼后沿垂直距离/头长(VDSOP/HL)、眼径/头长(ED/HL)等14个标准化性状,进行R -聚类分析和逐步判别分析[17],筛选出雌雄群体间具有差异显著的性状,并建立半刺厚唇鱼雌雄判别方程。运用Excel 2007和SPSS 20.0统计软件对数据进行处理。
2 结果与分析
2.1 半刺厚唇鱼雌雄个体形态性状指标分析
半刺厚唇鱼雌雄个体各项形态性状指标的统计分析及单因素方差分析的结果见表1。半刺厚唇鱼雌雄个体变异程度较大的前3个形态性状均为体质量、尾长和尾长/体长,其中雌性个体变异系数分别为29.289%、27.681%和29.152%,雄性个体分别为25.868%、24.346%、23.211%。各项形态性状指标中,雄性半刺厚唇鱼的头宽、眼径、眼间距、胸鳍长/尾长的变异程度大于雌性,其余指标均为雄性变异程度小于雌性。对60尾半刺厚唇鱼雌雄个体形态性状进行差异显著性分析,结果表明雌雄群体间体长、躯干长、尾长、躯干长/体长、尾长/体长、尾柄高/体长、头高/头长等7个性状存在显著差异(P<0.05),其余形态性状差异不显著(P﹥0.05)。
表1 半刺厚唇鱼形态性状统计量
Tab.1
| 性状Traits | 雄性Male | 雌性Female | ||
|---|---|---|---|---|
| 均值±标准差Mean±SD | 变异系数/% CV | 均值±标准差Mean±SD | 变异系数/% CV | |
| 体质量/g BW | 97.947±25.337 | 25.868 | 105.713±30.963 | 29.289 |
| 全长/cm TL | 20.030±1.687 | 8.421 | 20.847±1.927 | 9.245 |
| 体长/cm BL | 16.203±1.454* | 8.976 | 17.080±1.743* | 10.203 |
| 躯干长/cm TL | 7.610±0.798* | 10.492 | 8.450±1.032* | 12.219 |
| 体高/cm BD | 4.733±0.497 | 10.503 | 4.843±0.606 | 12.514 |
| 体厚/cm BT | 2.450±0.296 | 12.068 | 2.553±0.467 | 18.276 |
| 头长/cm HL | 4.490±0.411 | 9.161 | 4.627±0.514 | 11.107 |
| 头高/cm HD | 3.150±0.331 | 10.504 | 3.153±0.403 | 12.787 |
| 头宽/cm HB | 2.073±0.210 | 10.128 | 2.080±0.194 | 9.312 |
| 吻长/cm SL | 1.750±0.181 | 10.370 | 1.767±0.212 | 12.015 |
| 眼径/cm ED | 0.850±0.082 | 9.647 | 0.847±0.068 | 8.048 |
| 眼间距/cm EC | 1.390±0.179 | 12.863 | 1.403±0.143 | 10.161 |
| 吻端至眼后沿垂直 距离/cm VDSOP | 1.873±0.191 | 10.199 | 1.917±0.209 | 10.882 |
| 胸鳍长/cm PFL | 3.183±0.231 | 7.243 | 3.263±0.310 | 9.504 |
| 尾鳍长/cm CFL | 3.590±0.346 | 9.631 | 3.650±0.374 | 10.245 |
| 尾长/cm CPL | 7.040±1.714* | 24.346 | 6.050±1.675* | 27.681 |
| 尾柄高/cm CPD | 1.757±0.181 | 10.323 | 1.733±0.251 | 14.480 |
| 躯干长/体长TL/BL | 0.469±0.019* | 4.065 | 0.494±0.023* | 4.723 |
| 体高/体长BD/BL | 0.292±0.017 | 5.715 | 0.284±0.021 | 7.331 |
| 体厚/体长BT/BL | 0.151±0.013 | 8.790 | 0.149±0.020 | 13.447 |
| 头长/体长HL/BL | 0.277±0.013 | 4.580 | 0.272±0.022 | 8.103 |
| 胸鳍长/体长PFL/BL | 0.197±0.013 | 6.423 | 0.192±0.012 | 6.326 |
| 尾鳍长/体长CFL/BL | 0.222±0.015 | 6.973 | 0.214±0.017 | 7.906 |
| 尾长/体长CPL/BL | 0.435±0.101* | 23.211 | 0.358±0.104* | 29.152 |
| 尾柄高/体长CPD/BL | 0.108±0.006* | 5.138 | 0.102±0.011* | 11.122 |
| 头高/头长HD/HL | 0.701±0.028* | 4.041 | 0.681±0.029* | 4.241 |
| 头宽/头长HB/HL | 0.462±0.025 | 5.304 | 0.451±0.029 | 6.374 |
| 吻长/头长SL/HL | 0.390±0.016 | 4.204 | 0.383±0.029 | 7.697 |
| 眼径/头长ED/HL | 0.190±0.013 | 6.674 | 0.184±0.015 | 7.898 |
| 眼间距/头长EC/HL | 0.309±0.023 | 7.321 | 0.305±0.025 | 8.270 |
| 吻端至眼后沿垂直 距离/头长VDSOP/HL | 0.417±0.019 | 4.540 | 0.416±0.037 | 8.827 |
注:*表示差异显著(P<0.05)。
Note: * indicated significant difference (P<0.05).
2.2 主成分分析
为了简化半刺厚唇鱼的外部形态特征,明确半刺厚唇鱼的形态指标体系,对半刺厚唇鱼17个直接测量的形态性状进行主成分分析(表2)。其中前3个主成分的贡献率分别为70.056%、8.284%、4.674%,累积贡献率达到83.014%, KMO值为0.897。主成分1中负荷量较大的指标有体质量、全长、体高等,其反映了鱼体整体的大小特征;主成分2中负荷量较大的是尾长;主成分3无负荷量较大的性状。
表2 半刺厚唇鱼主成分的贡献率和各指标的负荷量
Tab.2
| 性状Traits | 主成分Principal components | ||
|---|---|---|---|
| 1 | 2 | 3 | |
| 体质量/g BW | 0.959 | -0.045 | 0.110 |
| 全长/cm TL | 0.939 | -0.078 | 0.271 |
| 体高/cm BD | 0.937 | -0.032 | -0.165 |
| 头长/cm HL | 0.913 | 0.210 | -0.116 |
| 体长/cm BL | 0.912 | -0.146 | 0.336 |
| 头宽/cm HB | 0.907 | -0.021 | -0.191 |
| 吻长/cm SL | 0.891 | 0.190 | 0.015 |
| 头高/cm HD | 0.890 | 0.202 | -0.183 |
| 眼间距/cm EC | 0.879 | -0.113 | -0.067 |
| 胸鳍长/cm PFL | 0.856 | -0.298 | -0.163 |
| 体厚/cm BT | 0.849 | -0.030 | -0.364 |
| 吻端至眼后沿垂直距离/cm VDSOP | 0.799 | 0.094 | 0.152 |
| 躯干长/cm TL | 0.791 | -0.235 | 0.433 |
| 尾鳍长/cm CFL | 0.788 | -0.244 | -0.190 |
| 尾柄高/cm CPD | 0.722 | 0.063 | 0.221 |
| 眼径/cm ED | 0.711 | 0.383 | -0.096 |
| 尾长/cm CPL | 0.130 | 0.938 | 0.130 |
| 贡献率/% Variance explained | 70.056 | 8.284 | 4.674 |
| 累积贡献率/% Cumulative contribution | 70.056 | 78.340 | 83.014 |
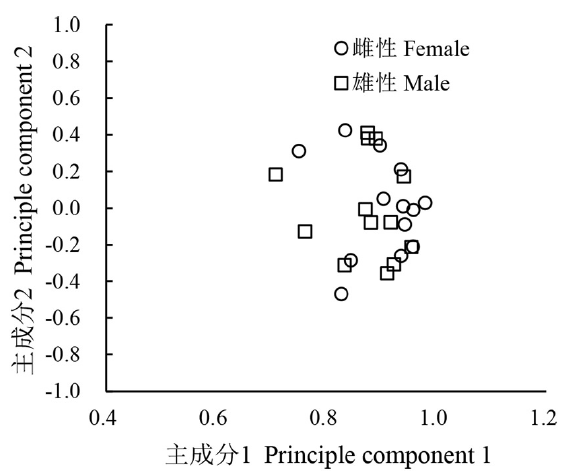
根据主成分得分,对雌雄个体的主成分1、主成分2绘制散布图。从图2可以看出,半刺厚唇鱼雌雄个体间出现重叠交错,但仍有分离态势。
图2
图2
半刺厚唇鱼雌雄性个体在主成分1和主成分2的分布
Fig.2
Distribution of principal component of male and female A. hemispinus
2.3 R-聚类分析
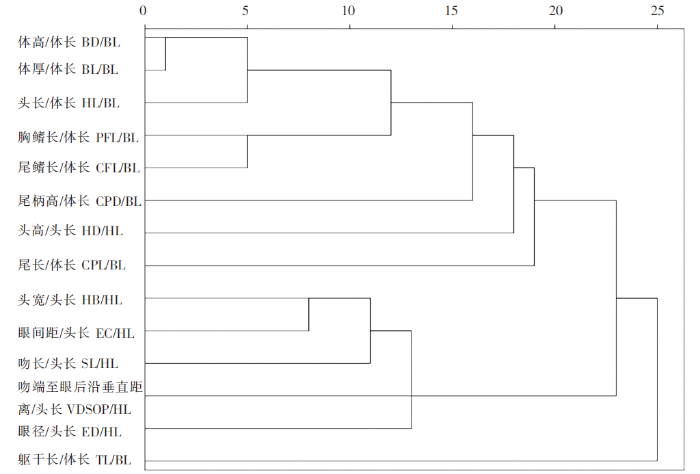
对60尾半刺厚唇鱼的14个标准化性状进行R-聚类分析(图3),这些标准化性状可以大致分为3大类:Ⅰ类包含体高/体长、体厚/体长、头长/体长、胸鳍长/体长、尾鳍长/体长、尾柄高/体长、头高/头长、尾长/体长,主要反映整体轮廓的特征参数;Ⅱ类包含头宽/头长、眼间距/头长、吻长/头长、吻端至眼后沿垂直距离/头长、眼径/头长,主要反映头部形态的特征参数;Ⅲ类为躯干长/体长,主要反映鱼体大小的特征参数。
图3
图3
半刺厚唇鱼标准化性状R-聚类分析
Fig.3
R-Cluster dendrogram of standardized indices for A. hemispinus
2.4 雌雄个体的判别模型
对60尾半刺厚唇鱼雌雄个体的14个标准化性状进行逐步判别分析,根据各变量对判别模型的贡献大小,逐步剔除不相关变量,最终筛选出4个变量:躯干长/体长(X1)、尾长/体长(X2)、尾柄高/体长(X3)、头高/头长(X4)(变量单位均为%),建立的判别模型方程如下所示。
雄:F1=917.211X1+78.772X2+1 898.439X3+814.049X4-621.398
雌:F2=976.079X1+71.879X2+1 809.187X3+774.359X4-610.235
利用所建立的判别模型方程,对60尾半刺厚唇鱼雌雄个体进行性别回判。将每尾个体的4个特征参数代入方程,分别计算F1和F2,若F1>F2,则为雄性;若F1<F2,则为雌性。经过判别方程验证(表3),雌性个体判别成功率为76.7%,雄性个体判别成功率为86.7%,综合判别成功率为81.7%。
表3 半刺厚唇鱼判别模型函数验证结果
Tab.3
| 性别Sex | 数量Number | 判别结果Discriminant results | 准确率/% Accuracy | 综合准确率/% Total accuracy | |
|---|---|---|---|---|---|
| 雌Female | 雄Male | ||||
| 雄Male | 30 | 4 | 26 | 86.7 | 81.7 |
| 雌Female | 30 | 23 | 7 | 76.7 | |
2.5 T检验
对所建立的判别方程中的4个变量进行T检验分析(表4),结果显示,躯干长/体长、尾长/体长、尾柄高/体长、头高/头长在半刺厚唇鱼雌雄两性群体间差异极显著(P<0.01),表明半刺厚唇鱼雄性个体躯干、尾部较长,雌性个体尾柄、头部较高。
表4 半刺厚唇鱼判别模型变量的T检验分析和雌雄形态差异
Tab.4
| 比例性状 Traits | 性别 Sex | 数量 Number | 均值±标准差 Mean±SD | T检验T-test | 雌雄形态差异 Morphological differences between males and females | |
|---|---|---|---|---|---|---|
| |t| | P | |||||
| 躯干长/体长 TL/BL | ♂ | 30 | 0.469±0.019 | 4.513 | 0.000** | 雌性躯干显著较长 |
| ♀ | 30 | 0.494±0.023 | ||||
| 尾长/体长 CPL/BL | ♂ | 30 | 0.435±0.101 | 2.928 | 0.005** | 雌性尾部显著较长 |
| ♀ | 30 | 0.358±0.104 | ||||
| 尾柄高/体长 CPD/BL | ♂ | 30 | 0.108±0.006 | 2.968 | 0.004** | 雄性尾柄显著较高 |
| ♀ | 30 | 0.102±0.011 | ||||
| 头高/头长 HD/HL | ♂ | 30 | 0.701±0.028 | 2.758 | 0.008** | 雄性头部显著较高 |
| ♀ | 30 | 0.681±0.029 | ||||
注:**表示差异显著(P<0.01)。
Note: **indicated extremely significant difference (P<0.01).
3 讨论
鱼类性别研究是水产养殖育种工作中的重要部分,包括雌雄个体差异分析、性逆转研究以及性别调控机制研究。有研究发现,部分鱼类雌性个体生长速度较雄性快,如长江口银色鳗(Anguilla japonica)[18]、金钱鱼(Scatophagus argus)[19]等,而尼罗罗非鱼(Oreochromis niloticus)[20]、乌苏里拟鲿(Pseudobagrus ussuriensis)[21]等雄性个体生长速度则快于雌性。鱼类自然性逆转现象在热带及亚热带的海水鱼类中普遍存在,最为常见的方式是首先以一种性别发育成熟,然后经历一个过渡阶段,再转变成另外一种性别[22-23]。鱼类的性逆转主要受遗传因素控制,但也易受环境因子、激素水平等多种因素影响[24],而温度则为主要环境影响因子[25]。因此可以通过控制温度及激素水平对鱼类性别进行调控。
3.1 雌雄个体形态性状差异
形态学研究是鱼类繁殖与选育的重要内容,也是开展雌雄个体差异分析、性别判别的基础。目前,有关半刺厚唇鱼的形态学研究尚未见报道,而本研究对半刺厚唇鱼17个直接测量的形态性状进行主成分分析,结果表明,前3个主成分的累积贡献率达到83.014%,这3个主成分代表了鱼体整体的大小特征和尾部特征。R-聚类分析结果显示,半刺厚唇鱼雌雄个体间的差异主要集中在鱼体的整体轮廓和头部形态特征,主成分分析结果与R-聚类分析结果基本一致。通过对这些个体外部形态性状指标的测定与分析,基本可以反映半刺厚唇鱼的外部形态特征。
本试验对60尾半刺厚唇鱼雌雄个体形态性状进行差异显著性分析,结果显示半刺厚唇鱼形态差异主要集中在尾部、头部和躯干,其中雄性的尾柄、头部显著高于雌性,而雌性的躯干、尾部显著长于雄性,与周惠强等[26]研究的结果:大刺鳅(Mastacembelus armatus)雌性比雄性躯干较长相似。
3.2 雌雄个体的判别
本试验对60尾半刺厚唇鱼雌雄个体的14个标准化性状进行逐步判别分析,利用本文建立的判别模型方程对半刺厚唇鱼雌雄个体进行性别回判,结果表明半刺厚唇鱼雄性个体判别成功率为86.7%,雌性个体判别成功率为76.7%,综合判别成功率为81.7%。有研究表明,大刺鳅雌、雄群体的综合判别准确率为69.2%[26];大黄鱼(Larimichthys crocea)雌鱼判别准确率为74.07%、雄鱼判别准确率为82.14%,总体的判别准确率为 76.83%[27];河川沙塘鳢(Odontobutis potamophila)雌性判别准确率为74.80%,雄性判别准确率为68.90%,综合判别率为71.00%[17];红鳍东方鲀(Takifugu rubripes)雌鱼的判别准确率为90.9%,雄性的判别准确率为75.0%,综合判别准确率为84.2%[28];杂交黄颡鱼(Pelteobagrus fulvidraco)“黄优1号”雌性判别准确率为83.9%,雄性判别准确率为84.4%,综合判别的准确率达到84.2%[29],这些均与本试验结果类似,表明在生产实践中,只需测量半刺厚唇鱼的躯干长、体长、尾长、尾柄高、头高以及头长这6个形态指标,就可以快速鉴别半刺厚唇鱼的性别,而且建立形态学判别方程是鉴定鱼类性别的一种行之有效的方法。
参考文献
饥饿对半刺厚唇鱼(Acrossocheilius hemispinus)仔鱼早期发育的主要影响
[J].
饲料中不同蛋白质水平对半刺厚唇鱼幼鱼生长性能及消化酶活性的影响
[J].为确定半刺厚唇鱼幼鱼的蛋白质需要量,以鱼粉和豆粕为蛋白源,添加鱼油、豆油、α-淀粉、纤维素以及适量的维生素和矿物质配制成试验饲料。蛋白质质量分数设置26%、30%、34%、38%、42%、46%等6个水平,饲养平均体重(12.51±0.15g)的半刺厚唇鱼幼鱼56 d后,以增重率、饲料系数和肠道消化酶活性为评价指标,分析不同蛋白水平的饲料对半刺厚唇鱼幼鱼生长和体内消化酶活性的影响。结果表明:在6个试验组中,增重率最大的为42P组,其次为38P组,两组之间显著不差异(P>0.05),增重率最小的26P组;饲料系数随蛋白质水平递增呈现出先逐渐减小后升高的趋势,其中42P组的饲料系数最小,其次为38P组,但两者差异不显著(P>0.05)。试验鱼肠道胰蛋白酶活性表现出随着饲料中蛋白质水平的增加而先升后降的趋势,其中38P组的胰蛋白酶活性最高且显著高于其它试验组(P<0.05)。综上所述,考虑到饲料成本和对养殖水环境的氮磷排放率等因素,半刺厚唇鱼幼鱼配合饲料中适宜的蛋白质水平为38%。
Histological profiling of gonads depicting protandrous hermaphroditism in Eleutheronema tetradactylum
[J].The fourfinger threadfin Eleutheronema tetradactylum is reported as a protandrous hermaphrodite from Australian waters, while being a gonochorist in reports from Singapore and India, with a single report of protandrous hermaphroditism from the latter. Histological analysis of gonads of fish from Indian waters confirms protandrous hermaphroditism in E. tetradactylum. The study was based on 480 fish examined from eight locations along the Indian coast. Mean total length (L ) of male fish was 240 mm with the transition to female starting from 280 mm L. Specimens confirmed as mature females were >380 mm L.© 2017 The Fisheries Society of the British Isles.
Evolutionary perspectives on hermaphroditism in fishes
[J].Hermaphroditism is a derived and polyphyletic condition in fishes, documented in about 2% of all extant teleost species scattered across more than 20 taxonomic families in 9 orders. It shows a variety of expressions that can be categorized into sequential and synchronous modes. Among the sequential hermaphrodites are protogynous species in which an individual begins reproductive life as a female and later may switch to male, protandrous species in which a fish starts as a male and later may switch to female, and serial bi-directional sex changers. Among the synchronous hermaphrodites (in which an individual can simultaneously produce eggs and sperm) are several outcrossing and one predominantly selfing species. A few species also consist of mixtures of hermaphroditic and single-sex individuals. All of these reproductive categories have been the subject of numerous theoretical and empirical treatments from an evolutionary perspective. Here we highlight some of the major conclusions from these studies, which collectively have been informative on a variety of biological topics related to reproductive modes, gender allocations, sexual conflict and gamesmanship, mating systems, and life-history tradeoffs.2009 S. Karger AG, Basel.
A comparative analysis of chemically induced sex reversal in teleosts: challenging conventional suppositions
[J].
Gonad development examination of high-temperature-treated genetically female Nile tilapia
[J].